Titre
Pourquoi
En cours de procédure, des contrôles de qualité internes doivent être effectués pour savoir si chaque étape de la procédure est effectuée correctement et si la qualité du résultat de cette procédure est contrôlée.
Quoi
Pour chaque procédure dans le laboratoire, des contrôles internes de la qualité doivent être formulés. Pour cela, il faut utiliser les organigrammes élaborés dans l'activité précédente. Pour chaque étape du processus dans chaque organigramme, il faut réfléchir aux défaillances possibles. Des contrôles internes de la qualité doivent ensuite être élaborés pour permettre la détection d'une défaillance au moment où elle se produit. De cette manière, la qualité de l'étape du processus est contrôlée. Pour que la qualité de l'ensemble du processus soit contrôlée, autant de contrôles internes de la qualité que nécessaire doivent être inclus.
Une liste des contrôles internes de la qualité par procédure doit être établie. Elle ne doit pas se limiter aux procédures relatives aux examens. Ainsi, la préparation des réactifs, la préparation des milieux, la vérification de la transcription des résultats dans les rapports de résultats, etc. doivent également être soumises à des étapes de contrôle de la qualité. Les résultats des contrôles internes de la qualité doivent être archivés. Ces archives doivent être utilisées pour la révision périodique des résultats du contrôle de la qualité.
Le manuel Système de gestion de la qualité au laboratoire (LQMS) de l'OMS fournit de nombreuses informations sur le contrôle de la qualité ; dans la colonne de droite figure un lien vers ces documents.
Comment & qui
Responsable qualité, en concertation avec les membres du personnel du laboratoire impliqués dans les différentes procédures :
- Voir la figure ci-dessous :
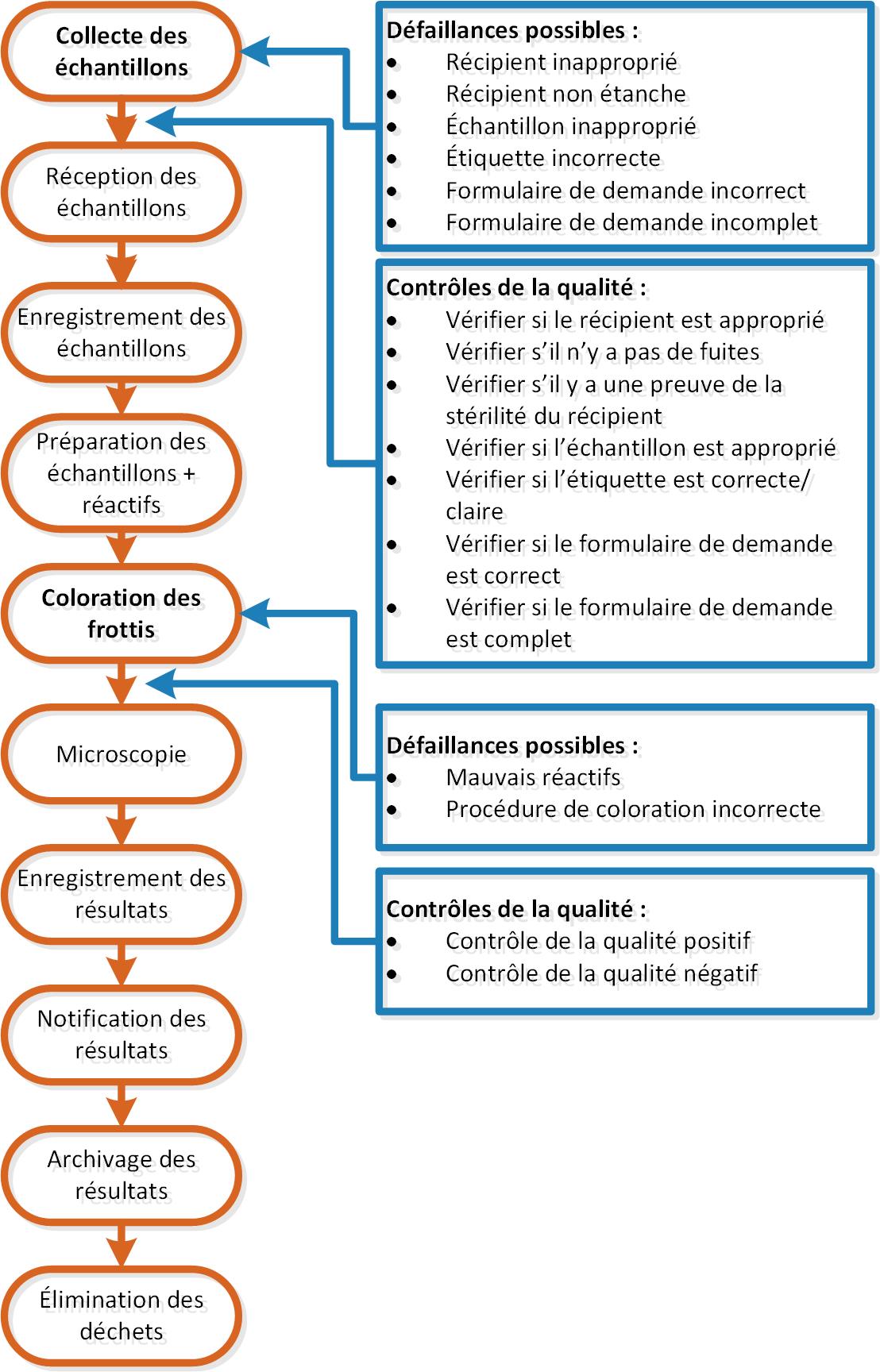
- Utiliser les organigrammes élaborés dans l'activité précédente : pour chaque étape du processus, déterminer les défaillances possibles (et les consigner par écrit en regard de l'étape du processus).
- Pour chaque défaillance possible, formuler l'étape du contrôle de la qualité qui permettra de détecter la défaillance au moment où elle se produit. On trouvera ci-dessous une illustration dans laquelle cette détection et l'étape précédente ont été effectuées pour deux étapes du processus de l'analyse des colorations de Gram.
- Pour chaque procédure, faire une liste des contrôles internes de la qualité qui doivent être institués et déterminer également la fréquence avec laquelle ces contrôles doivent avoir lieu (par exemple, "quotidien", "hebdomadaire", "pour chaque nouveau lot", etc.).
- Le protocole spécifique pour la réalisation des contrôles internes de la qualité varie selon la procédure. Le protocole pour la réalisation des contrôles de la qualité doit donc être inclus dans les POS pour chaque procédure. Cela signifie que le contrôle de la qualité doit faire partie intégrale de toutes les procédures réalisées dans le laboratoire. Si des POS ont déjà été élaborées pour certaines procédures, elles doivent être adaptées de manière à y inclure les protocoles et les formulaires se rapportant au contrôle de la qualité. Si des POS n'ont pas encore été développées pour certaines procédures : plus tard durant cette phase, des POS doivent être élaborées pour toutes les procédures ordinaires réalisées dans le laboratoire.
- Adapter les registres de résultats afin de prévoir une place pour indiquer les données de contrôle de la qualité.
- Rédiger une POS relative au contrôle interne de la qualité selon le protocole de rédaction d'une POS relative aux procédures dans la POS-cadre et utiliser le modèle de POS relative aux procédures joint à la POS-cadre. Dans la POS relative au contrôle interne de la qualité, la procédure générale pour effectuer un contrôle interne de la qualité doit être décrite. Inclure dans cette POS les éléments suivants :
- Explication du concept de contrôle interne de la qualité ; de quoi il s'agit et pourquoi il faut le faire.
- La procédure générale pour la réalisation d'un contrôle interne de la qualité et l'explication de la nécessité de consigner les données du contrôle de la qualité dans le registre du laboratoire. Ces données permettent d'effectuer des contrôles de la qualité et de suivre les tendances du contrôle de la qualité dans le laboratoire (voir ci-dessous).
- Procédure pour la constitution de matériels utilisés comme témoins pour le contrôle interne de la qualité : ils doivent imiter autant que possible les matériels prélevés sur le patient. Expliquer également quelles étapes de contrôle sont nécessaires pour s'assurer que les matériels utilisés comme témoins sont de bonne qualité. Se reporter aux POS relatives aux procédures spécifiques au laboratoire concernant les protocoles pour la constitution de matériels utilisés comme témoins spécifiques au contrôle interne de la qualité dans le cas d'un examen ou procédure particulier.
- La procédure relative à l'examen périodique des données de contrôle interne de la qualité afin de détecter les tendances dans la façon d'effectuer les contrôles internes de la qualité qui peuvent indiquer des problèmes dans les examens. Utiliser des techniques statistiques pour le suivi continu des contrôles internes de la qualité. Pour plus d'informations, voir l'activité suivante.
- La procédure qui doit être suivie en cas de défaillance d'un contrôle interne de la qualité (signifiant que l'étape du processus couverte par le contrôle de la qualité n'a pas été effectuée correctement et que la qualité de la réalisation/du résultat de l'ensemble de la procédure est compromise). Les résultats ne doivent jamais être communiqués en cas de défaillance du contrôle de la qualité ! Voir également le point suivant
- Élaborer un formulaire de non-conformité. Les défaillances du contrôle de la qualité doivent être enregistrées sur ce formulaire. Il sera nécessaire plus tard en phase 3 quand les rapports trimestriels et les revues de direction devront être produits. Dans la colonne de droite, figure un lien vers un modèle de formulaire de ce type. Conserver les formulaires remplis dans un nouveau classeur intitulé "Non-conformités".
- Inclure la POS dans la liste Lu et Compris et indiquer quels membres du personnel doivent lire la POS (ceux qui sont concernés par la POS dans leur travail).
- Présenter, lors d'une réunion hebdomadaire du personnel, le concept de contrôle interne de la qualité et la POS relative au contrôle interne de la qualité et expliquer tous les éléments de la POS mentionnés ci-dessus. Expliquer qui doit effectuer quel contrôle de la qualité et à quel moment. Indiquer quels membres du personnel doivent lire la POS et indiquer qu'ils doivent signer la liste Lu et Compris quand ils auront lu la POS.
- Commencer à utiliser les contrôles internes de la qualité comme décrit dans la POS relative au contrôle interne de la qualité.
- Dans les premiers stades : vérifier que les contrôles internes de la qualité sont correctement effectués et selon le calendrier. Si ce n'est pas le cas : trouver l'origine du problème. Par exemple, si un membre du personnel n'a pas compris comment le contrôle interne de la qualité doit être effectué pour un examen particulier, lui expliquer à nouveau la procédure.